Il est à noter que l’utilisation majoritaire des batteries de type AGM vient de l’implantation de véhicules équipés de systèmes de Start & Stop. Actuellement, la plupart des véhicules disposent de ce type de batteries vu le rendement important de celles-ci.
Start-Stop
Qu’est-ce qu’une batterie AGM ?
Les batteries AGM appartiennent aux batteries de la famille VRLA dont les sigles signifient (Valve Regulated Lead Acid), c’est-à-dire des batteries d’acide de plomb régulées à l’aide de soupapes.
Leur structure est semblable à celles des batteries traditionnelles ; ce sont des batteries humides de plomb-calcium. Elle est composée du même nombre de plaques, positives (peroxyde de plomb) et négatives (plomb spongieux) fournissant une tension nominale de 12 volts.
La nouveauté de la batterie de type AGM se fonde sur le séparateur en fibre de verre disposé entre les plaques qui absorbent l’électrolyte et l’eau distillée.
Quelles sont leurs caractéristiques ?
Les gaz de l’électrolyte générés lors des phases de décharge et de charge se transforment en eau.
Les électrodes des plaques fixent la fibre de verre par pression, qui par conséquent est toujours en contact étanche et uniforme avec les électrodes, minimisant la perte de matériau actif causée par les vibrations.
-En cas de production de vapeur d’eau, à haute pression (entre 20 et 200 millibars), le système utilise une soupape de surpression, libérant le gaz dans l'atmosphère, en évitant cependant le passage de l’oxygène atmosphérique à l’intérieur de la batterie.
Soupape de dégazage
-Les dimensions des plaques sont supérieures à celles des plaques traditionnelles.
-L’intensité du cycle d’échange énergétique (décharge et charge) peut être jusqu’à trois fois supérieure grâce à la disposition de séparateurs en fibre de verre.
Section AGM
L’acide de la batterie est imprégné dans la fibre de verre.
Comment fonctionne une batterie ?
Processus de décharge
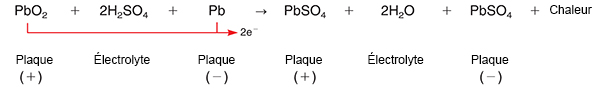
Lorsqu’un consommateur est connecté entre les bornes de la batterie, un circuit électrique externe s’établit, du fait de la différence de potentiel entre les deux plaques ou électrodes par leur nature différente ; le processus de décharge se produit.
Le processus consiste à transformer l’énergie chimique en énergie électrique, en générant de cette manière un courant d’électrons qui circule de la plaque négative à la plaque positive de la batterie par l’extérieur de l’accumulateur, et de positif à négatif par l’intérieur (électrolyte).
Souvenez-vous : Le sens conventionnel du courant électrique est de (+) à (-), mais son sens réel est le contraire, de (-) à (+).
Sa décomposition chimique a lieu de la manière suivante : l’acide sulfurique (H2SO4) se décompose en créant des ions de sulfate (SO4=) et des ions d’hydrogène (2H+), auxquels le sulfate se combine aux plaques.
Phase de décharge
Sur la plaque positive se décompose le peroxyde de plomb, se transformant en sulfate de plomb (PbSO4), ce qui libère de l’oxygène (O2).
Sur la plaque négative, le sulfate (SO24) réagit avec le plomb, formant également du sulfate de plomb (PbSO4) se forme également. Les ions d’oxygène et d’hydrogène libérés au cours des deux réactions se combinent pour former de l’eau (H2O), qui s’accumule à l’intérieur du mélange comme partie d’électrolyte de la batterie. La décomposition de l’électrolyte (eau + acide sulfurique) diminue sa densité.
Ces transformations chimiques qui se déroulent à l’intérieur de la batterie provoquent un courant électrique dû à l’altération des éléments chimiques entre les deux plaques.
Processus de charge
Lorsque le processus de charge de la batterie commence, ce processus se produit dans le sens contraire à celui de la décharge ; il se base sur la transformation du courant électrique provenant d’un générateur (alternateur) en énergie chimique. Les électrons circulent de la plaque positive à la plaque négative, ce qui provoque un processus de réaction inverse à la décharge.
L’eau de l’électrolyte générée au cours du processus de décharge se décompose par électrolyse en ses ions (2H+) et (O2) , grâce auxquels l’oxygène de l’eau réagit avec le plomb de la plaque positive. De sorte que se forme à nouveau le peroxyde de plomb (PBO2). Le sulfate (SO4=) des deux plaques se libère en provoquant la réaction de l’hydrogène avec le sulfate, l’acide sulfurique se formant ainsi à nouveau (H2SO4).
Phase de charge
La composition de l’électrolyte (eau + acide sulfurique) augmente sa densité.
Les cycles de décharge et de charge qui se produisent à l’intérieur de la batterie provoquent la dégradation des éléments chimiques qui la forment, limitant leur durée de vie utile qui est exprimée en nombre de cycles.
Quels sont ses avantages ?
- Absence de gazéification au cours des processus d’électrolyse. - Haute résistance à l’auto-décharge.
- Bonnes propriétés du démarrage à froid. - Puissance spécifique supérieure. - Elles peuvent être placées sur n’importe quelle partie et à n’importe quel endroit du véhicule. - Elles ne requièrent pas d’entretien.
Quels sont ses inconvénients ?
- Elles ne peuvent pas être manipulées. Le contact de l’oxygène extérieur altérerait leur équilibre chimique et leur ferait perdre leur fonctionnalité.
- Le prix est clairement supérieur à celui des batteries conventionnelles d’acide.
- Elles ne peuvent pas être installées dans des compartiments où elles risquent de souffrir de fortes oscillations de température.
- Lorsqu’elles sont manipulées ou remplacées, les protections thermiques dont elles disposent doivent être respectées.
Vu leur coût élevé, certains fabricants ont choisi de remplacer la fibre de verre par du polyester, ce qui entraîne le fait qu'elles ne présentent pas les mêmes capacités.
Le type de batterie recommandée pour notre véhicule doit prendre en compte les spécifications indiquées par le fabricant. Il faut toujours respecter le type de batterie et les capacités afin d’éviter d’endommager l’ensemble électronique de la charge que possèdent certains véhicules.
Pour plus d’informations, il vous est recommandé de consulter votre fournisseur ou votre distributeur le plus proche.










Aucun commentaire:
Enregistrer un commentaire